Bagian 1
-
Asam butanoat merupakan isomer gugus fungsi dari metil propanoat.SEBABAsam butanoat dan metil propanoat memiliki rumus molekul C4H8O2.Jawaban : a
Asam butanoat merupakan turunan alkana yaitu asam karboksilat atau asam alkanoat dengan struktur
CH3 – CH2 – CH2 – COOH
Sedangkan metil propanoat merupakan turunan alkana yaitu ester atau alkil alkanoat dengan struktur
CH3 – CH2 – COO – CH3
Keduanya merupakan isomer gugus fungsi karena memiliki rumus molekul sama yaitu C4H8O2 tapi gugus fungsinya berbeda. Pada asam karboksilat gugus fungsinya –COOH sedangkan pada ester gugus fungsinya –COO–.
-
- PbO2 + 4HCl → PbCl2 + 2H2O + Cl2
- 2Al + 3Cu(NO3)2 → 2Al(NO3)3 + 3Cu
- CS2 + 3O2 → CO2 + SO2
- ZnSO4 + KCl → ZnCl2 + K2SO4
Jawaban : aReaksi redoks adalah reaksi kimia yang ditandai dengan kenaikan biloks (oksidasi) sekaligus penurunan biloks (reduksi).
Persamaan reaksi 1,2 dan 3 merupakan redoks.
Sedangkan persamaan reaksi 4 bukan redoks, karena tidak terjadi kenaikan maupun penurunan biloks.
-
- 3-metil-2-butanol
- 2-metil-2-butanol
- 3-metil-3-butanol
- 3-etil-1-propanol
- 3-pentanol
Jawaban : aSenyawa yang memiliki rumus molekul C5H12O, yaitu alkohol dan eter. Antara keduanya yang dapat mengalami oksidasi adalah alkohol.
Alkohol primer bila dioksidasi akan menghasilkan senyawa aldehid dan jika dioksidasi lagi akan menghasilkan asam karboksilat sedangkan alkohol sekunder bila dioksidasi akan menghasilkan senyawa keton. Pada opsi di atas, senyawa alkohol yang dapat dengan mungkin berubah menjadi senyawa keton adalah pilihan A. Pilihan B mempunyai cabang pada atom karbon yang terikat dengan gugus OH sehingga sulit untuk menjadi senyawa keton, sedangkan pilihan C terdapat kesalahan pada tata nama.
-
Suatu cuplikan hanya mengandung unsur nitrogen dan oksigen. Bila dalam 152 gram cuplikan terdapat 56 gram nitrogen, maka rumus empiris senyawa tersebut adalah ....
(ArN:14, O:16)
- N2O5
- N2O3
- N2O
- NO2
- NO
Jawaban : bCuplikan mengandung N dan O saja.
Massa cuplikan 152 gram
Massa nitrogen 56 gram.
Massa oksigen = 152 gram – 56 gram = 96 gram
Rumus empiris dari perbandingan terkecil mol atom N dan O yaitu
mol N : mol O = 56/14 : 96/16
= 4 : 6
= 2 : 3
-
Nomor atom X adalah 26. Konfigurasi elektron ion X3+ adalah 1s2 2s2 2p6 3s2 3p6 4s2 3d3.SEBABIon X3+, artinya atom X melepas 3 elektron terluarnya.Jawaban : d
Konfigurasi elektron atom 26X adalah 1s2 2s2 2p6 3s2 3p6 4s2 3d6.
Ion X3+, artinya atom X melepas 3 elektron terluarnya, maka elektron yang terlepas dari orbital 4s kemudian 3d.
Sehingga konfigurasi elektron ion 26X3+ adalah 1s2 2s2 2p6 3s2 3p6 4s0 3d5.
-
Alkohol sekunder dapat diubah menjadi keton dengan menggunakan KMnO4 atau K2Cr2O7 menurut persamaan reaksi:
R1 – CHOH – R2 → R1 – CO – R2
Jenis reaksi yang terjadi adalah ....
- eliminasi
- reduksi
- hidrolisis
- substitusi
- adisi
Jawaban : aPerubahan terjadi pada gugus fungsi alkohol dan keton.
R1 – CHOH – R2 → R1 – CO – R2
Dari reaksi tersebut, terjadi pembuangan 2 atom H (pada -CHOH-) di kiri panah menjadi CO saja di kanan panah. Reaksi pembuangan atom itu disebut sebagai reaksi eliminasi.
-
Jawaban : a
Untuk membuat hibridisasi yang dilihat adalah atom pusat. Pada senyawa XeF4 yang menjadi atom pusat adalah Xe.
Konfigurasi elektron 54Xe = [Kr] 5s2 4d10 5p6

-
SEBABJawaban : a
Asam kuat H2SO4 dengan pH =1
[H+] = 10-1
[H+] = a Ma , Ma =
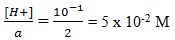
Dilakukan pengenceran 100 kali, misal V1 = 1 ml maka V2 = 100 ml
Maka M2 menjadi
M1 V1 = M2 V2
M2 =
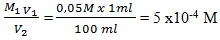
pH setelah pengenceran
[H+] = a Ma
[H+] = 2 x 5 x10-4 = 10-3
pH = -log 10-3 = 3
jadi pernyataan larutan asam kuat H2SO4 dengan pH =1 diencerkan 100 kali, maka pH larutan menjadi 3 itu benar. Alasannya, Jumlah ion H+ dalam larutan berubah menjadi sedikit bila larutan diencerkan.
-
Sebanyak 4,16 gram gas A terbentuk dari reaksi antara 1 liter gas NO2 dan gas O2 berlebih menurut reaksi
4NO2(g) + O2(g) → 2A(g)
Jika reaksi tersebut berlangsung pada suhu 300C dengan tekanan 2 atm, maka massa molekul relatif gas A adalah .... (R=0,082 liter atm/mol K)
76
104
112
224
316
Jawaban : bMassa gas A 2,24 gram
Suhu 300C + 273 =303 K
Tekanan 2 atm
Persamaan reaksi
4NO2(g) + O2(g) → 2A(g)
1 liter 0,5 liter
Persamaan gas ideal
P V = n R T
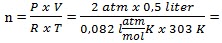 0,04 mol
0,04 molmaka Mr =
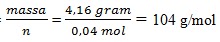 = 104 g/mol
= 104 g/mol -
Jawaban : b
Persamaan reaksi
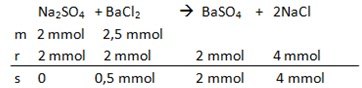
1) Na2SO4 sebagai reaksi pembatas (benar)
2) Sisa [Ba2+] = 0,5 mmol/100ml = 5 x 10-5 M (salah)
3) Ksp BaSO4 = 1,0 x 10-10, maka kelarutannya dalam air
BaSO4 → Ba2+ + SO42-
Ksp = s s
Ksp = s2
S =
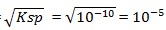 M (benar)
M (benar)4)
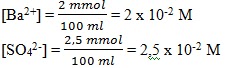
Maka Q = [Ba2+] [SO42-]
= 2 x 10-2 x 2,5 x 10-2 = 5 x 10-4
Nilai Q > Ksp, maka terbentuk endapan BaSO4 ( salah)
Bagian 2
-
Suatu sel elektrokimia dengan elektrode Zn dan Ag pada keadaan standar menghasilkan arus 0,75 A selama 321 menit. Diketahui nilai
E0 Zn2+ I Zn = - 0,76 V
E0 Ag+ I Ag = + 0,8 V
Maka pengurangan massa di anoda adalah .... gram (F = 96.500 C)
Jawaban : bKatoda : Ag+ + e → Ag
Anoda : Zn → Zn2+ + 2e-
Wanoda =
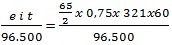 = 4,875 gram
= 4,875 gram -
Proses pemurnian belerang yang dilakukan oleh Frasch dikenal juga dengan proses penambangan sumur panas. Konsep kerjanya adalah dengan mengalirkan air panas kedalam sumur galian yang terdapat deposit belerang, sehingga belerang akan meleleh dan mengapung pada permukaan air. Namun diawal proses ini, Frasch mengalami permasalahan. Suhu tertinggi dari air panas adalah 100oC, namun belerang memiliki titik lebur pada suhu 101,6o C.
Analisis, cara manakah di bawah ini yang paling tepat untuk menyelesaikan masalah yang dihadapai Frasch? (diketahui
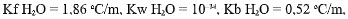 Ar S = 32 g/mol, Ar H = 1 g/mol, O = 16 g/mol).Jawaban : b
Ar S = 32 g/mol, Ar H = 1 g/mol, O = 16 g/mol).Jawaban : b(A) Jawaban A salah, karena menaikan tekanan air akan menggugurkan tanah meningkatkan sedimen, sehingga lebih sulit untuk mendapat belerang murni.
(B) Jawaban B benar. Menambahkan 0,09 kg NaCl atau 90 gram NaCl disetiap liter air akan menaikan suhu air sekitar 1,6oC (sehingga titik didih menjadi air 101,6oC) dan sama dengan titik leleh belerang dalam deposit, sehingga belerang akan didapatkan.

(C) Jawaban C salah. Menambahkan HCl akan merusak alat – alat pertambangan yang umumnya dari logam.
(D) Menambahkan alkohol 10% pada setiap liter air tidak berpengaruh, karena belerang tidak larut dalam alkohol.
(E) Meningkatkan volume air yang masuk tidak akan mempengaruhi, karena konsep kerjanya adalah melelehkan belerang.
-
SEBABJawaban : a

-
Diketahui reaksi redoks (belum setara):
PbSO4(s)+H2O(l)→Pb(s)+PbO2(s)+H2SO4(aq)
Pernyataan berikut ini yang benar adalah ....
- PbSO4 berperan sebagai oksidator
- PbSO4 berperan sebagai reduktor
- Pada akhir reaksi pH laturan lebih kecil dari 7
- Perbandingan mol PbSO4 terhadap H2O adalah 1:2
Jawaban : a
Pernyataan yang benar adalah 1, 2, dan 3.
-
Jawaban : b

-
30
60
120
180
360
Jawaban : b
Sehingga dapat dimasukkan:

-

Pernyataan berikut ini yang benar mengenai diagram energi di atas adalah....
Jawaban : c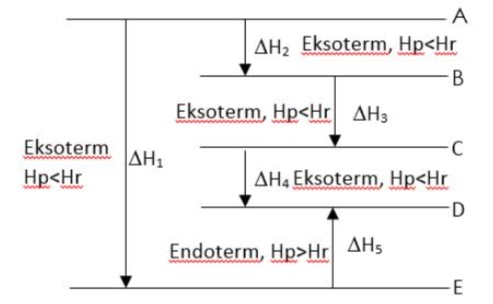
Pada reaksi ekstorem, terjadi perpindahan kalor dari sistem ke lingkungan, sehingga suhu lingkungan akan meningkat. Sebaliknya, pada reaksi endoterm terjadi perpindahan kalor dari lingkungan ke sistem. Sehingga suhu lingkungan akan menurun (menjadi lebih dingin).
-
SEBABJawaban : d
Salah satu faktor yang mempengaruhi kesetimbangan adalah volume. Jika volume diperbesar, maka kesetimbangan akan bergeser ke arah koefisien yang lebih besar. Sebaliknya, jika volume diturunkan maka kesetimbangan akan bergeser ke arah koefisien yang lebih kecil. Pada reaksi H2(g) + I2(g)⇌2HI(g), koefisien kanan dan kiri sama, yaitu 2. Sehingga perubahan volume tidak akan menggeser kesetimbangan atau volume tidak mempengaruhi sistem kesetimbangan ini.
Pernyataan pertama salah dan pernyataan kedua benar.
-
Jawaban : d
Berdasarkan hukum Gay Lussac, untuk reaksi gas maka perbandingan volume = perbandingan koefisien gas – gas yang terlibat dalam reaksi
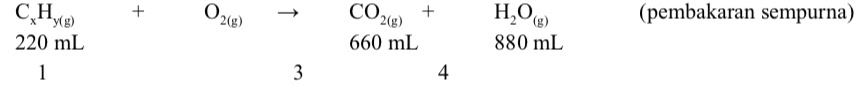
Sehingga,

-
Jawaban : b
Ikatan hidrogen adalah ikatan antarmolekul yang terjadi antara atom atom H dalam satu molekul dengan atom yang lebih elektronegatif yaitu O, N, F pada molekul lain. Karena pada molekul H2O terdapat molekul O dan H, dan pada molekul C2H5OH juga mempunyai ikatan O dan H pada gugus fungsi alkohol sehingga nomor 1 dan 3 akan berinteraksi dengan ikatan hidrogen. Gambaran interaksi antarmolekul H2O dan C2H5OH adalah sebagai berikut:
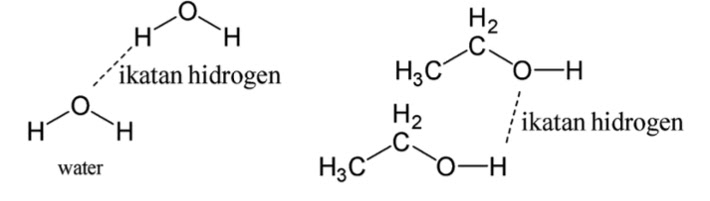
Bagian 3
-
Jawaban : e

Jika panjang rusuk tegak limas P.ABC adalah a, b, c dan tinggi t maka limas P.KLM memiliki panjang rusuk tegak ½ a, ½ b, ½ c, dan tinggi ½ t
Perbandingan volume limas P.KLM dengan limas terpancung ABC KLM adalah:
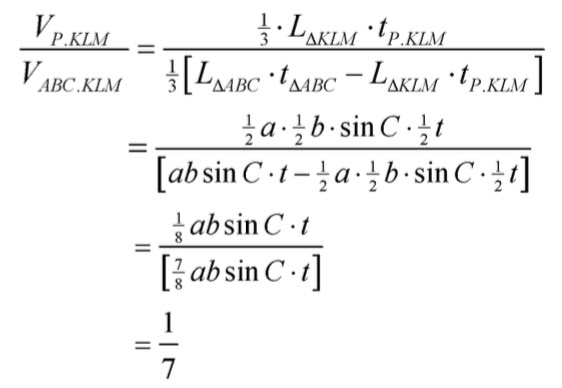
-
Berikut merupakan persamaan reaksi pembentukan gas SO3:
SO2(g) + O2(g) → SO3(g)
Jika gas oksigen yang digunakan sebanyak 12 L, maka volume gas SO3 yang dihasilkan adalah....
Jawaban : dPersamaan reaksi setara untuk penguraian gas SO3 adalah sebagai berikut:
2SO2 (g) + O2 (g) → 2SO3 (g)
Menurut hukum Gay Lussac, perbandingan volume spesi dalam reaksi fase gas sebanding dengan koefisien spesi tersebut.
Jika volume gas O2 = 12 L, maka:
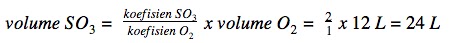
-
Jawaban : e
Reaksi pembentukan oksida logam MxOy adalah sebagai berikut:
M + O2 → MxOy
0,5 mol 0,625 mol 0,25 mol
Perbandingan mol ≈ perbandingan koefisien. Perbandingan mol spesi tersebut adalah 4 : 5 : 2. Sehingga perbandingan koefisien spesi tersebut juga 4 : 5 : 2.
4M + 5O2 → 2MxOy
Untuk menentukan nilai x dan y, dilihat dari jumlah atom – atom.
Jumlah atom kiri harus sama dengan jumlah atom kanan.Atom M kiri = atom M kanan
4 = 2x
x = 2
Atom O kiri = atom O kanan
10 = 2y
Y = 5
Sehingga rumus oksida tersebut adalah M2O5.
-
Perhatikan reaksi pembentukan amonia berikut:
N2(g) + H2(g) ⇌ NH3(g)
Pada suhu dan tekanan yang sama, perbandingan volume gas-gas yang terlibat dalam reaksi tersebut secara berurutan adalah....
Jawaban : bBerdasarkan Hukum Gay Lussac, pada suhu dan tekanan yang sama, volume gas – gas yang terlibat dalam reaksi sebanding dengan koefisien dalam reaksi tersebut.
Reaksi pembentukan amonia setelah setara adalah sebagai berikut:
N2(g) + 3H2(g) ⇌ 2NH3(g)
Sehingga perbandingan volume gas N2, H2 dan NH3 berturut – turut adalah 1 : 3 : 2.
-
Jawaban : b
Untuk mencari kelimpahan persen isotop di alam, maka dapat dimisalkan persen kelimpahan masing-masing isotopnya :
Kelimpahan isotop Cl35 = a %
Kelimpahan isotop Cl37 = (100 – a) %

sehingga :
Isotop Cl35 = 75%
Isotop Cl37 = 100 – 75% = 25%
-
Reaksi pembentukan Titanium (IV) florida berlangsung sebagai berikut:
3 TiO2 (s) + BrF3 (l) → 3 TiF4 (s) + Br2 (l) + O2 (g)
Bila 3.2 gram cuplikan yang mengandung TiO2 menghasilkan 0.64 gram O2, maka persentase massa TiO2 dalam cuplikan tersebut adalah…. (Ar. Ti : 48, O : 16, F : 19, Br : 80)
Jawaban : cReaksi di atas belum setara, maka disetarakan terlebih dahulu:
3 TiO2 (s) + 4 BrF3 (l) → 3 TiF4 (s) + 2 Br2 (l) + 3 O2 (g)
mol O2 = massa/Mr = 0,64/32 = 0,02 gram
Karena koefisien O2 dan koefisien TiO2 sama, maka mol TiO2 sama dengan mol O2 yaitu 0.02 mol
maka massa TiO2= mol x Mr =0,02 x 80 = 1,6 gram
% TiO2 dalam cuplikan = 1,6/3,2 x 100% = 50%
-
SEBABJawaban : a
Menurut hukum Avogadro, pada P dan T yang sama, gas-gas yang mempunyai volume sama akan memiliki jumlah molekul yang sama, sehingga:
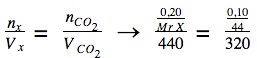
Mr X = 64
Gas SO2 memiliki Mr sebesar 64. Sehingga pernyataan pertama dan kedua adalah benar dan kedua pernyataan tersebut saling berkaitan.
-
Jawaban : d

-
Dalam setiap 100 gram urea (CO(NH2)2) terdapat 42 gram nitrogen. Persentase kemurnian dari pupuk urea tersebut adalah....
(diketahui Ar N = 14, C = 12, O = 16, H = 1)
Jawaban : eMr CO(NH2)2 = Ar C + Ar O + 2xAr N + (4xAr H)
Mr CO(NH2)2 = 12 + 16 + 2x14 + (4x1)
Mr CO(NH2)2 = 60
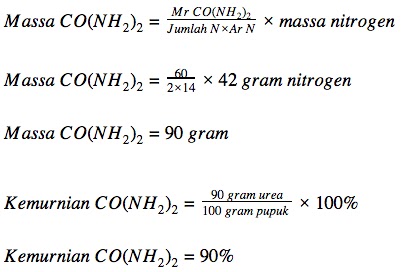
-
Suatu cuplikan yang mengandung pirit (FeS) seberat 88 gram bereaksi dengan HCl sehingga menghasilkan FeCl2 dan gas H2S. Jika dihasilkan produk berupa 15 L H2S yang diukur pada saat 2,5 L gas Nitrogen bermassa 3,5 gram, maka persentase massa FeS pada cuplikan tersebut adalah....
(Ar Fe = 56, Cl = 35,5, H = 1, S = 32, N = 14)
Jawaban : dFeS + 2HCl → FeCl2 H2S
Jumlah gas H2S yang dihasilkan dari reaksi diukur pada keadaan gas Nitrogen → Hukum Avogadro
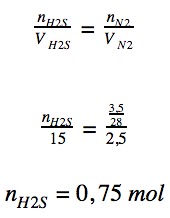
Karena koefisien FeS = koefisien H2S, maka mol FeS = mol H2S. Sehingga :
nH2S = nFeS = 0,75 mol
massa FeS = (0,75 mol x 88 gram/mol)
massa FeS = 66 gram
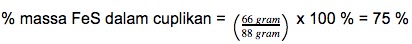
Bagian 4
-
Jawaban : b
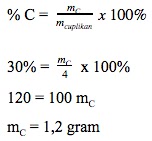
dengan menganggap massa sebelum = massa sesudah reaksi, maka massa C dalam cuplikan akan sama dengan massa C dalam CO2. Sehingga:
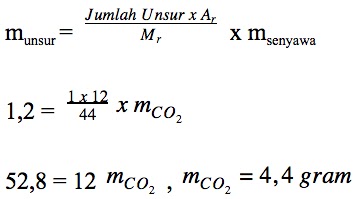
-
Gas etana C2H6 (Mr = 30) sebanyak 60 gram direaksikan dengan gas bromin (Br2) hingga gas etana habis dan ternyata hanya menghasilkan 282 gram C2H4Br2 (Mr = 188) dan x gram C2H2Br4 (Mr = 346). Massa C2H2Br4 yang dihasilkan adalah....
34,6 gram
79,2 gram
173 gram
188 gram
346 gram
Jawaban : cReaksi 1 : C2H6 + Br2 → C2H4Br2 + H2
Reaksi 1 : C2H6 + 2 Br2 → C2H2Br4 + 2H2
mol C2H4Br2 = 282/188 = 1,5 mol → mol C2H6 = 1,5 mol
mol C2H2Br4 = x/346 mol → mol C2H6 = x/346 mol
mol C2H6 total = 60/30 = 2 mol
2 = 1,5 + (x/346)
0,5 = x/346
x = 173 gram
maka massa C2H2Br4 yang dihasilkan adalah 173 gram.
-
Gula 0,1 mol dan 0,1 mol garam LX dengan derajat ionisasi 0,5 masing masing dilarutkan dalam 1 liter air (ρ = 1 g/mL). Jika penurunan titik beku larutan gula t oC, maka penurunan titik beku larutan garam LX adalah....
0,25 t oC
0,5 t oC
0,75 t oC
t oC
1,5 t oC
Jawaban : eGula
ΔTf = m.Kf
t = (0,1/1). Kf
Kf = t/0,1
Garam
ΔTf = m.Kf.i
= (0,1/1)(t/0,1)[1+(2-1)0,5]
= 1,5 t oC
-
Diketahui beberapa reaksi kimia berikut ini.
(i) CH3 – CH2 – CHO + H2 → CH3 – CH2 – CH2 – OH
(ii) CH3 – CO – Cl + CH3 – OH → CH3 – COO – CH3 + HCl
(iii) CH3 – CH2 – Cl → CH2 = CH2 + HCl
Pernyataan yang BENAR atas reaksi di atas adalah ....
reaksi (i) merupakan reaksi reduksi.
reaksi (ii) merupakan reaksi substitusi.
reaksi (iii) merupakan reaksi eliminasi.
reaksi (i) merupakan reaksi adisi.
Jawaban : a(i) CH3 – CH2 – CHO + H2 → CH3 – CH2 – CH2 – OH (Reaksi : reduksi → aldehid menjadi alkohol primer)
(ii) CH3 – CO – Cl + CH3 – OH → CH3 – COO – CH3 + HCl (Reaksi substitusi)
(iii) CH3 – CH2 – Cl → CH2 = CH2 + HCl (Reaksi eliminasi)
-
SEBAB
Proses atau reaksi O2(g) → O–2(g) melibatkan energi atomisasi dan afinitas elektron.
Pada proses tersebut gas oksigen teratomisasi terlebih dahulu dan kemudian menangkap 2 elektron.
Jawaban : aMemutus ikatan = energi atomisasi
Menerima elektron = afinitas elektron
-
Larutan A memiliki konsentrasi Na2SO4 sebesar 0,2 M, sedangkan larutan B memiliki konsentrasi sukrosa sebesar 0,5 M. Perbandingan tekanan osmotik larutan A terhadap larutan B pada temperatur yang sama adalah ....
1 : 2
2 : 3
3 : 4
6 : 5
4 : 7
Jawaban : d= ΠNa2SO4 : Πsukrosa
= M . R . T . i : M . R . T
= 0,2 . 3 : 0,5
= 6 : 5
-
SEBAB
Kelarutan AgCl dalam air dapat ditingkatkan dengan menambahkan NH3 ke dalam larutan.
Penambahan NH3 akan mengurangi konsentrasi Ag+ dengan membentuk Ag(NH3)2+.
Jawaban : aReaksi inti: AgCl → Ag+ + Cl–
Bila ditambah NH3 maka akan mengikat Ag+ membentuk Ag(NH3)2+ sehingga reaksi bergeser ke kanan artinya kelarutan AgCl bertambah.
-
SEBAB
Ion logam pada elektrolisis akan selalu mengendap pada katoda.
Pada katoda akan terjadi proses reduksi.
Jawaban : aKatoda terjadi reaksi reduksi.
Anoda terjadi reaksi oksidasi.
-
Uji identifikasi berikut yang menunjukkan adanya formaldehid dalam suatu makanan adalah ….
Dengan larutan Fehling membentuk endapan merah bata.
Dengan larutan [Ag(NH3)2]+ membentuk endapan Ag.
Dengan larutan K2Cr2O7 membentuk asam karboksilat.
Dengan biuret menghasilkan cincin berwarna ungu.
Jawaban : aFormaldehid adalah aldehid.
Uji aldehid antara lain:
Fehling → positif (terbentuk endapan merah bata).
Tollens → positif (terbentuk endapan Ag).
Oksidasi K2Cr2O7 → terbentuk asam alkanoat.
Sedangkan Biuret bukan untuk uji aldehida tetapi untuk uji protein. -
Pernyataan yang benar tentang H3PO4, H2SO4, dan HClO4 adalah ….
HClO4 merupakan oksidator kuat.
H3PO4 merupakan asam terlemah.
Pada konsentrasi 0,1 M larutan H2SO4 memiliki pH terendah.
Na3PO4 merupakan basa paling kuat dibandingkan Na2SO4 dan NaClO4.
Jawaban : eHClO4 → asam terkuat, mudah melepas H+, mudah mengalami reduksi.
H3PO4 → asam terlemah
pH H2SO4 0,1 M adalah [H+] = 2 . 10-1,
pH = 1 – log 2
Na3PO4 terbentuk dari basa kuat dengan asam lemah.
Bagian 5
-
Interaksi yang dominan antara molekul pelarut dan zat terlarut yang terdapat pada larutan etilen glikol dalam air adalah ….
gaya London
ikatan hidrogen
dipol terinduksi – dipol permanen
ion – dipol permanen
ion-ion
Jawaban : dDalam etilen glikol interaksi yang dominan antar molekulnya adalah dipol terinduksi – dipol permanen.
-
Asam oksalat adalah asam berbasa dua. Sebanyak 10 mL larutan asam oksalat diencerkan dengan air sampai volumenya 100 mL. Larutan ini digunakan untuk menitrasi 20 mL larutan NaOH 0,2 M dengan indikator bromtimol biru. Bila titik akhir titrasi diperoleh saat volume asam oksalat mencapai 25 mL, maka konsentrasi larutan asam oksalat awal adalah ….
0,80 M
0,40 M
0,80 M
1,60 M
3,20 M
Jawaban : cAsam = Basa
molar . volume . valensi = molar . volume . valensi
x . 25 . 2 = 0,2 . 20 . 1
x . 50 = 4
x = 4/50
= 0,08 M
Karena sudah diencerkan 10x, maka konsentrasi awal : 0,8 M.
-
Suatu senyawa organik diperoleh sebagai produk samping dari hidrolisis lemak, pembuatan biodiesel, dan pembuatan sabun dari minyak atau lemak. Senyawa ini banyak digunakan sebagai zat aditif pada cairan pendingin radiator mobil, dan bereaksi dengan logam Na menghasilkan gas H2. Senyawa ini adalah ….
trigiserida
etanol
gliserol
asam asetat
etil asetat
Jawaban : cHasil samping sabun : Gliserol.
-
Hidrolisis suatu makromolekul menghasilkan senyawa yang mempunyai gugus amino dan karboksilat. Makromolekul tersebut dapat berfungsi sebagai biokatalis yang mempercepat hidrolisis amilum. Makromolekul tersebut adalah ….
amilase
amilosa
amilopektin
amilalkohol
glikogen
Jawaban : aAmilase berfugsi sebagai biokatalis hidrolisis amilum.
1 2 3 4 5